【中学受験】楽しい理科一問一答 水溶液② 水溶液の性質の表と覚え方

前回は中学受験の理科における水溶液とは何なのかをやっていきました。今回は水溶液の性質について解説し、最後に一問一答を載せております。
やっていくのは酸性、中性、アルカリ性という水溶液の性質と中和という現象についてです。実際に家庭で目で見て確認できるように、家にあるものを使って色の変化を紹介しています。
え?紫キャベツを煮出したのかって?
いやー、紫キャベツがね、スーパーになかったんですよ。しかも、煮出すのを考えるとだるくてですね、私はウェルチを使いました。
意味わからない?ウェルチです。ウェルチ。あのブドウジュースのウェルチ。
紫キャベツに含まれている色素はアントシアニンです。このアントシアニンという色素が水溶液の性質によって色を変える、というわけです。で、ブドウの皮にもアントシアニンは含まれております。
だったらウェルチでもいけるでしょ!
というわけでウェルチを指示薬として使いました。
今回用意した(というか家にあった)のはこちら!ジャジャン。

こちらのなんとも家庭的な実験道具を使ってやっていきたいと思います。
▼参考サイト
青少年科学教室 ムラサキキャベツで水溶液の性質を調べよう(PDF)
赤シソや赤キャベツの煮汁にお酢を加えると色が変わるのはなぜですか?(キリヤ科学株式会社)
水溶液の性質により色が変化する
酸性、中性、アルカリ性っていう3つの水溶液の性質によって指示薬の色が変化するって話は聞いたことあるよね?
BTB溶液、フェノールフタレイン溶液、リトマス紙、紫キャベツ・・・。
でも本当に試してみたことはあるかい?
自分の目で見たことのないものをどうやって信じるんだろうか?
嘘かもしれない。
そこで実際にやってみた。
用意したのはこれだ。
| 物質名 | 性質 | 役割 |
| サンポール | 酸性 | ウェルチを酸性にする |
| 食塩水 | 中性 | ウェルチをそのままの性質に保つ |
| 重曹水 | アルカリ性 | ウェルチをアルカリ性にする |
| クエン酸水 | 酸性 | サンポールが使えなかった時の予備 |
| ウェルチ | ー | 指示薬 |
どの教科書にもウェルチを指示薬として使うなんてのは書いてないよ。
でもね、ウェルチにはアントシアニンっていう色素が含まれているはずで、こいつは紫キャベツに含まれているものと同じだ。つまり、酸性とアルカリ性の水溶液を入れたら色が変わるはずだと考えた。
紫キャベツも探したけどどこにも売ってないし、だいたい売ってたとしても煮込むのが面倒臭い。
ウェルチなら金で解決だ。
ちなみに水溶液が酸性かアルカリ性かを知るための物質を指示薬と言う。今回はウェルチが指示薬だ。
さあ、これで準備万端、ばっちこい。
ところが、いきなりハプニング発生だ。
サンポールを使おうとしたところ、とんでもないことに気が付いてしまったんだ。

・・・。
って、サンポールめっちゃ緑色やんけ。
塩酸が入っているからちょうどいいと思ったのだけど、サンポールは緑色すぎて実験にならない。条件が同一じゃないからね。
というわけで、予備として用意しておいたクエン酸を使うことにした。
あらためて今回実験に使ったのはこれだ。

どれも透明だ。条件は同一。クエン酸水は酸性、食塩水は中性、重曹水はアルカリ性。
これをウェルチにぶち込んだらウェルチの色は変わるはず。
では当初のウェルチの色を見ていこう。
すなわちビフォーアフターのビフォーだ。
▼ビフォー

当たり前だけども、どれもウェルチ色だ。赤紫っぽい。
ではこのウェルチに用意したクエン酸水、食塩水、重曹水をぶち込む。
きっとすごい変化があるに違いない。
これがウェルチのアフターだ。
▼アフター

ん?あんまり変わってないぞ?
ただ、一番左のクエン酸をぶち込んだウェルチは若干色が赤っぽくなったような気がするし、重曹水をぶち込んだウェルチはやや黒っぽくなった気がする。
これだけだとよく分からない。そこでティッシュにそれぞれのウェルチ溶液を染み込ませてみた。
それがこれだ。

これで分かるだろうか?
写真では分かりにくいかもしれないけれど、クエン酸(酸性)を混ぜたウェルチはかなり鮮やかな赤色になった。
食塩水(中性)を混ぜたウェルチは赤紫色だ。
そして重曹水(アルカリ性)を混ぜたウェルチは青緑色っぽく変色した。
水溶液の性質により色素が変化するのは分かったかな?
ウェルチでも実験できる。ぜひやってみてほしい。
では色の変化を指示薬ごとに整理してみようか。
水溶液の性質による指示薬の色の変化
酸性、中性、アルカリ性といった水溶液の性質による指示薬の色の変化は以下の通りだ。
| 溶液名 | 酸性 | 中性 | アルカリ性 |
| ウェルチ | 赤 | 紫 | 青緑 |
| 紫キャベツ液 | 赤 | 紫 | 黄色 |
| BTB溶液 | 黄色 | 緑 | 青 |
| フェノールフタレイン | 無色 | 無色 | 赤 |
| 赤色リトマス紙 | 赤(変化なし) | 赤(変化なし) | 青 |
| 青色リトマス紙 | 赤 | 青(変化なし) | 青(変化なし) |
上のうち、ウェルチは覚えなくてもいい。
100%、入試問題には出ないからだ。
他の指示薬の変化は覚えておこう。
さて、覚えるために上の表に色をつけた。ウェルチは除外している。
| 溶液名 | 酸性 | 中性 | アルカリ性 |
| 紫キャベツ液 | 赤 | 紫 | 黄色 |
| 赤色リトマス紙 | 赤 | 赤 | 青 |
| 青色リトマス紙 | 赤 | 青 | 青 |
| BTB溶液 | 黄色 | 緑 | 青 |
| フェノールフタレイン | 無色 | 無色 | 赤 |
さて、まずは中性の水溶液を入れても指示薬の色は変化しない、と覚えておいてほしい。
だから、もともと赤色だった赤色リトマス紙は赤のままだし、もともと緑色のBTB溶液は緑、フェノールフタレインは無色透明のまま。
では、酸性の時の指示薬の色に注目してみよう。
基本的には赤だね。
だから、酸性は基本は「赤」と覚える。
そして、次にBTB溶液とフェノールフタレインは酸性の例外と頭に入れておく。
BTB溶液は黄色。
フェノールフタレインは酸性には反応せず、アルカリ性に反応する指示薬、とおぼえる。
まとめるよ。
酸性は赤、ただしBTB溶液は黄色、フェノールフタレインは酸性には反応しない。
同じようにアルカリ性も見てみよう。
基本は「青」だね。だからアルカリ性は基本的に「青」と覚えてしまう。
次に例外だ。
紫キャベツ液は黄色、フェノールフタレインは赤。
まとめるよ。
アルカリ性は青、ただし紫キャベツ液は黄色、フェノールフタレインはアルカリ性に反応して赤。
さて、ここまではいいかな?
色の変化については頭に入っただろうか?
余談だけれども、何かをおぼえる時には「基本と例外」に分けておぼえると頭に入りやすい。
ちょっとしたテクニックだ。
さて、紫キャベツ液についてもう少しやっていこう。
紫キャベツ液の色の変化
紫キャベツ液の色の変化は覚えているかな?
そう、酸性だと赤、中性は紫、アルカリ性は黄色。
紫キャベツ液の中に入っているアントシアニンという色素は水溶液の性質で色が変化する。
でもおかしいと思わなかったかい?
アントシアニンはウェルチの中にも入っている。
なのにウェルチにアルカリ性の水溶液(重曹水)を入れた時には青緑色になってしまった。
この現象をひもといていこう。
段階的に変化する紫キャベツ液の色
結論から言ってしまうと、紫キャベツ液の色、つまりアントシアニンの色は酸性の強さ、アルカリ性の強さによって色が変わる。
↓が色の変化だ。
▼紫キャベツ液の色の変化
| 強酸性 | 弱酸性 | 中性 | 弱アルカリ性 | 強アルカリ性 |
| 赤 | ピンク | 紫 | 青緑〜緑 | 黄色 |
酸性やアルカリ性にも強弱がある。
めっちゃ強いものからめっちゃ弱いものまでね。
ウェルチに重曹水を入れた時には青緑色になった、と言ったね。
つまり、僕がつくった重曹水は弱アルカリ性だった、ということだ。
本当は強アルカリ性のアンモニア水でも入れればウェルチを黄色にできたのかもしれない。
なお、ウェルチを黄色にしたくて、ウェルチの中にオシッコを入れるのはオススメしない。
オシッコはアンモニア水ではないからだ。
ちなみに下ではより詳しく説明してくれている。ぜひ読んでみてほしい。
青少年科学教室 ムラサキキャベツで水溶液の性質を調べよう(PDF)
酸性やアルカリ性の強弱ってなんだ?
強い酸性、弱い酸性、強いアルカリ性、弱いアルカリ性。
ここで強いとか弱いとか言ってるけど、そもそも強い弱いってのはなんのことだ?
君はそう思ったかもしれない。
水溶液の性質はpH(ペーハー)という数字であらわされる。この数字が小さいほど酸性が強く、大きいほどアルカリ性が強くなる。
では、紫キャベツ液の色の変化をpHで表してみよう。
▼pH(ペーハー)で見る紫キャベツ液の色の変化
| 強酸性 pH0〜2 | 弱酸性 pH3〜6 | 中性 pH7 | 弱アルカリ性 pH8〜11 | 強アルカリ性 pH12〜14 |
| 赤 | ピンク | 紫 | 青緑〜緑 | 黄色 |
pH(ペーハー)ってなんだ?
いきなり、pH(ペーハー)なんて数字を出してとまどったかもしれない。
中学受験のテキストや参考書ではあまり出てこない数字だ。
でもこれを知らないと酸性やアルカリ性がなんなのかは分からない。
これから難しい話をするよ。高校レベルの化学だ。
用意はいいかい?
pH(ペーハー)というのは水溶液の中の水素イオンの濃度のことだ。
pH(ペーハー)の数字が小さければ小さいほど水素イオンの濃度が濃く、大きければ大きいほど水素イオンの濃度は薄い。
水溶液に溶けている水素イオンが多いほど酸性になり、少なければアルカリ性。
つまり、小さい数字だったら酸性、大きい数字だったらアルカリ性。
なぜそうなのかはもっと説明がややこしくなる。お父さん、お母さんに聞いたら教えてくれるだろう。
僕がつくった重曹水はpH9(アルカリ性)くらい。クエン酸水はpH2(酸性)くらい。食塩水はpH7(中性)くらい。
さて、水溶液の性質が酸性なのかアルカリ性なのかは、水溶液に溶けている水素イオンの数と水酸化物イオンの数で決まる。
酸性の水溶液の中では水素イオンが水酸化物イオンよりも多い。
逆にアルカリ性の水溶液は水酸化物イオンの方が多い。
中性は同じ。
この関係をイメージできるように絵にした。
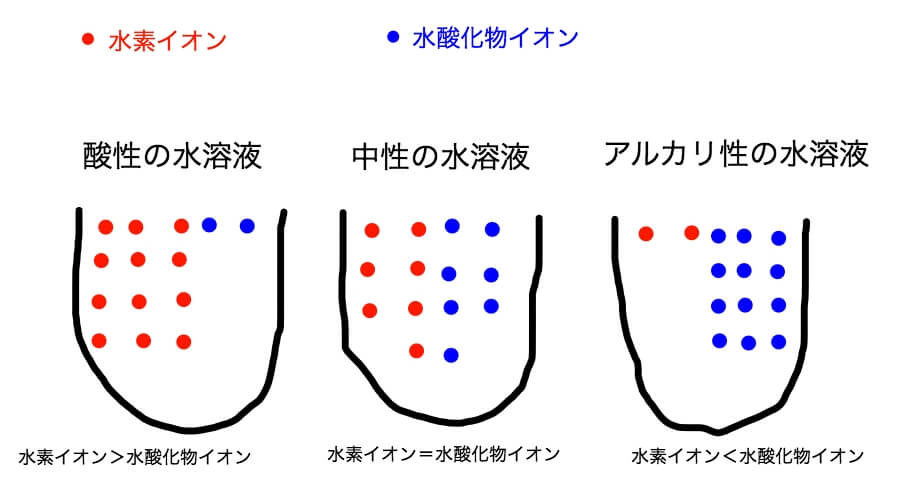
さて、酸性とかアルカリ性というものの正体が分かっただろうか?
酸性の水溶液は水素イオンの数が水酸化物イオンよりも多く、アルカリ性の水溶液は水素イオンの数が水酸化物イオンよりも少ない。
中性は数が同じ。
水素イオンが水溶液に多いほど酸性の性質。
水酸化物イオンが水溶液に多いほどアルカリ性の性質になる。
この辺は「ふーん、酸性とアルカリ性ってそういうものなのか」くらいで構わない。
なお、水素と水素イオンは別物だ。そもそも水素は水に溶けない。
ところで僕は昔、先生から、
「酸性の水溶液は酸っぱくてサラサラしている。アルカリ性の水溶液は苦くてヌルヌルしている」
と習った。
まあ大体はそうなんだけど、少なくとも僕がつくった重曹水(アルカリ性)はヌルヌルしていなかったし、サンポール(酸性)は酸っぱいというか・・・、やばい味がした。
※注 サンポールをなめてはいけません
僕の先生の説明は正確な定義じゃなかった。
酸性とアルカリ性の正確な定義は水素イオンと水酸化物イオンの数だ。
だから、もし酸っぱいとか苦いとかヌルヌルしているとかいう説明を受けた時には、
「中学受験レベルのざっくりした水溶液の世界では大体そんな感じ」
と頭では思いつつ、ちゃんと先生の話を聞くようにしよう。そして覚えよう。
水素イオン、水酸化物イオンなんてだいぶ混乱したんじゃないかな?
でも、これを説明しないと酸性やアルカリ性を説明するなんてとてもじゃないけどできない。僕が習った塾の理科の先生はイオンを説明せずに酸性やアルカリ性について語ってくれた。
きっと悩みつつ教えてくれていたのだと思う。
水素イオン、水酸化物イオンってなんだ?
水素イオンが多いと酸性。
水酸化物イオンが多いとアルカリ性。
水素イオンと水酸化物イオンが同じ数だと中性。
そう説明した。
でも、そもそも疑問に思うかもしれない。
「イオンってなんだ?」
ここからはさらにややこしい話になる。心して聞いてくれ。
イオンを説明するには原子というものについて説明しなければならない。
水素と水素イオンがどう違うのかイラストにしてみたよ。
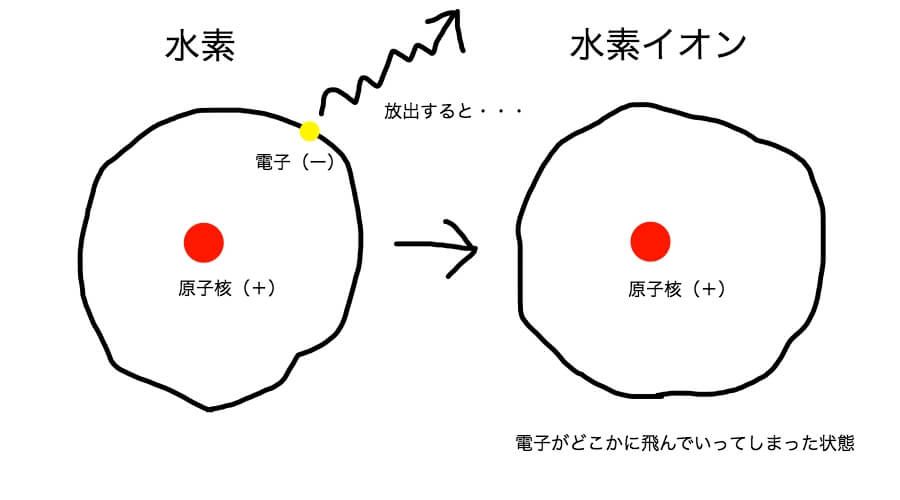
水素についてはテキストにも書いてあるね。これは原子という物質だ。
原子は世の中の全ての物質のおおもとだ。
原子ってやつは原子核と電子から成っている。
電子は原子核の周りを回っている。
そして、原子核は電気的にプラスの性質、電子はマイナスの性質を持っている。
で、水素イオンってのは電子が原子から離れて飛んでいってしまった物質のことだ。
すると水素イオンはプラスの性質を持つことになる。
水素原子はプラスの原子核とマイナスの電子でプラスマイナスゼロでつりあっていた。
ところがマイナスの性質を持った電子が飛んでいってしまったので、水素イオンは電気的にプラスの性質を持つようになるってわけだ。
逆に水酸化物イオンってのは、電子を受け取った状態の物質だ。だから電気的にはマイナスの性質を持つ。
ちなみに食塩水は中性だと習ったよね?
塩を水に溶かしてもナトリウムイオンと塩化物イオンに分かれるだけで、水素イオンも水酸化物イオンも発生しない。
だから中性なんだ。
塩化水素を水に溶かすと何ができるんだっけ?
そうだ、塩酸だ。
塩酸は酸性。つまり、水素イオンを発生させている。
塩化水素は水に溶かすと水素イオンと塩化物イオンに分かれる。
水素イオンが発生しているよね?
だから酸性。
砂糖を水に溶かすとどうか?
砂糖水ができるね。これは中性だと習ったはずだ。
ところが砂糖は塩と違い、水に溶かしてもイオンは発生しない。
水に溶けた砂糖はすごく小さくなるだけで、イオンは発生しないんだ。
だから砂糖水は中性だし、電気を通さない。
電気を通さない?
そうだ、電気を通すかどうかは水溶液にイオンが発生しているかどうかで決まる。
イオンと電流の関係
ある物質を溶かした時、イオンになるということは電気的にプラスだったりマイナスの物質が水溶液の中に存在するってことだ。
電気を通すとイオンを通じて電気が流れていく。
食塩水の中にはイオンが発生している。だから電気を通す。
砂糖水の中にはイオンが発生していない。だから電気を通さない。
イオンが発生している水溶液は電気を通すんだ。なぜならイオンという電気的性質を持った物質が水溶液に溶けているからね。
さぁ、ここまで説明してやっと水溶液の性質の表の意味が分かる。
▼水溶液の性質の表
| 水溶液 | 性質 | イオンになるか | 電気を通すか |
| 食塩水 | 中性 | なる | 通す |
| 砂糖水 | 中性 | ならない | 通さない |
| 石灰水 | アルカリ性 | なる | 通す |
| 重曹水 | アルカリ性 | なる | 通す |
| 水酸化ナトリウム水溶液 | アルカリ性 | なる | 通す |
| ホウ酸水 | 酸性 | なる | 通す |
| アルコール水 | 中性 | ならない | 通さない |
| さく酸水 | 酸性 | なる | 通す |
| アンモニア水 | アルカリ性 | なる | 通す |
| 炭酸水 | 酸性 | なる | 通す |
| 塩酸 | 酸性 | なる | 通す |
| 亜硫酸 | 酸性 | なる | 通す |
※石灰水は消石灰(水酸化カルシウム)を水に溶かした水溶液。石灰石ではない。石灰石は水に溶けない。
上の表から何か法則は見つけ出せるかな?
見つけ出せそうな気がするね。
一つ目の法則
アルカリ性か酸性の水溶液は必ず電気を通す。
二つ目の法則
アルカリ性か酸性の水溶液は必ずイオンが発生している。
で、例外は?
そうだ、食塩水だ。
食塩水は中性だけどイオンが発生するし、電気も通す。
塩は水に溶かすとナトリウムイオンと塩化物イオンが発生し、食塩水になる。水素イオンも水酸化物イオンも発生していないね。
だから中性で、かつ電気も通すって理屈だ。
まとめておくよ。
基本と例外 その1
基本:酸性とアルカリ性の物質は電気を通す。
例外:食塩水は中性なのに電気を通す。
基本と例外 その2
基本:イオンが発生している水溶液は酸性かアルカリ性である。
例外:食塩水はイオンが発生しているのに中性である。
水溶液と電流の性質 まとめ
いいかな?
酸性かアルカリ性だったら必ず電気を通すと覚えちゃうんだ。
そして、例外は食塩水のみ。
この理屈は超難しいイオンの話を理解してもらえれば分かるはずだ。
中和ってなんだ?
最後にサクッと終わらせたい。
中和というのは酸性とアルカリ性の物質同士を混ぜて、お互いの性質を打ち消す現象だ。
これを別の言葉で表してみるね。
「水素イオンと水酸化物イオンが反応する現象を中和」と言う。
さて、水素イオンと水酸化物イオンが反応すると何ができるだろうか?
水になる。
水素イオンと水酸化物イオンは反応して水に姿を変える。
つまり、水素イオンと水酸化物イオンが消えてしまうんだ。
そしたら水溶液の性質はどうなる?
そうだ、中性だ。
中和っていうのは酸性の水溶液に含まれている水素イオンと、アルカリ性の水溶液に含まれている水酸化物イオンが反応して水になる現象を言うんだ。
これが僕がつくったクエン酸水(酸性)と重曹水(アルカリ性)を混ぜた時の様子だ。

めちゃくちゃ泡が出ているね。これでも反応が落ち着いた時の様子なんだよ。
実はこの前にコップから泡があふれ出てきて超大変だった。
ちなみにこの泡は二酸化炭素だ。
だいぶ反応が落ち着いてからの写真がこれだ。

この水溶液は中性だ。酸性とアルカリ性の水溶液をいい感じで混ぜたからね。
試しになめてみたら、かなりやばい味がした。
塩辛くて、苦くて、酸っぱいような何とも言えないやばい味だった。
指示薬のウェルチにも入れてみたよ。
それがこれだ。

ティッシュに染み込ませた溶液はウェルチ色だ。すなわち中性。きちんと中和されたってわけだ。
ぜひやってみて欲しい。クエン酸と重曹だったらどこのスーパーにでも売ってる。
水溶液の性質 一問一答 問題編
1.塩酸の水溶液としての性質を答えよ
2.炭酸水の水溶液としての性質を答えよ
3.アンモニア水の水溶液としての性質を答えよ
4.食塩水の水溶液としての性質を答えよ
5.石灰水の水溶液としての性質を答えよ
6.ホウ酸水の水溶液としての性質を答えよ
7.砂糖水の水溶液としての性質を答えよ
8.重曹水の水溶液としての性質を答えよ
9.アルコール水の水溶液としての性質を答えよ
10.硫酸の水溶液としての性質を答えよ
11.塩酸は電気を通すか
12.炭酸水は電気を通すか
13.アンモニア水は電気を通すか
14.食塩水は電気を通すか
15.石灰水は電気を通すか
16.ホウ酸水は電気を通すか
17.砂糖水は電気を通すか
18.重曹水は電気を通すか
19.アルコール水は電気を通すか
20.硫酸は電気を通すか
21.次の中からフェノールフタレイン溶液を赤色にする水溶液を全て答えよ
アンモニア水、石灰水、食塩水、ホウ酸水、アルコール水、水酸化ナトリウム水溶液、さく酸水、重曹水、石灰水
22.フェノールフタレイン溶液を赤色にする水溶液の性質を答えよ
23.フェノールフタレイン溶液の色が変わらない水溶液の性質を答えよ
24.次の中からBTB溶液を黄色にする水溶液を以下より全て答えよ
アンモニア水、石灰水、食塩水、ホウ酸水、アルコール水、水酸化ナトリウム水溶液、さく酸水、重曹水、石灰水
25.BTB溶液を黄色にする水溶液の性質を答えよ
26.次の中からBTB溶液を青色にする水溶液を全て答えよ
アンモニア水、石灰水、食塩水、ホウ酸水、アルコール水、水酸化ナトリウム水溶液、さく酸水、重曹水、石灰水
27.BTB溶液を青色にする水溶液の性質を答えよ
28.次の中から青色リトマス紙の色を赤色にする水溶液を全て答えよ
アンモニア水、石灰水、食塩水、ホウ酸水、アルコール水、水酸化ナトリウム水溶液、さく酸水、重曹水、石灰水
29.次の中から赤色リトマス紙の色を青色にする水溶液を全て答えよ
アンモニア水、石灰水、食塩水、ホウ酸水、アルコール水、水酸化ナトリウム水溶液、さく酸水、重曹水、石灰水
30.酸性とアルカリ性の水溶液を混ぜて中性の水溶液を作ることを何と呼ぶか
31.30で作成した中性の水溶液をBTB溶液に入れると何色になるか
32.塩酸と水酸化ナトリウムを混ぜて中性の水溶液を作ることができるか
33.32の結果、何と何が作られるか
水溶液の性質 一問一答 解答編
1.酸性
2.酸性
3.アルカリ性
4.中性
5.アルカリ性
6.酸性
7.中性
8.アルカリ性
9.中性
10.酸性
11.通す
12.通す
13.通す
14.通す
15.通す
16.通す
17.通さない
18.通す
19.通さない
20.通す
21.アンモニア水、石灰水、水酸化ナトリウム水溶液、重曹水、石灰水
22.アルカリ性
23.酸性と中性
24.ホウ酸水、さく酸水
25.酸性
26.アンモニア水、石灰水、水酸化ナトリウム水溶液、重曹水、石灰水
27.アルカリ性
28.ホウ酸水、さく酸水
29.アンモニア水、石灰水、水酸化ナトリウム水溶液、重曹水、石灰水
30.中和
31.緑色
32.できる
33.塩と水
あわせて読みたい
最新のホカホカ記事
最新のホカホカ記事の一覧はこちらから書いている人の紹介
星一徹のプロフィールはこちらから- 前の記事

【中学受験】楽しい理科一問一答 水溶液① 水溶液とは?水溶液の定義と特徴 2019.04.20
- 次の記事

【中学受験】楽しい理科一問一答 水溶液③ 水に溶ける=溶解ってなんだろう? 2019.04.27

