【中学受験】楽しい理科一問一答 水溶液③ 水に溶ける=溶解ってなんだろう?

理科、水溶液の3回目でございます。いつものように解説の最後に一問一答を載せております。
理科の水溶液に関する中学受験入試問題は御三家、難関校レベルは一通り解きまして何を勉強すれば解けるのかがだいぶクリアになってまいりました。
解くコツ?そんなもんありませんよ。
ありきたりかもしれませんが、正確な知識の記憶と、記憶した知識を使って順を追って問題文の現象を整理する、とこれだけでございます。
そんなわけで今回も正確な知識の記憶のために、単純暗記にならないよう解説を付していくわけでございます。何回か申し上げておりますが単純暗記は忘れますからね。
私がアホなだけかもしれませんが、ちゃんと理屈や背景を分かっていないと三歩歩いたらたちまち忘れてしまうのであります。
ある程度基礎知識を説明していきましたら水溶液に関する実際の入試問題を解きつつ、どのように知識を使って、どのように考えて解くかをやっていこうと思います。
それまでは知識の記憶に焦点を絞ってやっていこうと思います。
もう少々ご辛抱くださいませ。
▼参考サイト
溶解ってなんだろう?
まずはおさらいだ。
水と塩と食塩水。それぞれをなんて呼ぶんだったったけね?
そうだ、水は溶媒と言うんだったね。
塩は溶質。
食塩水は溶液。
そして塩が水に解けること。これを溶解って言う。
今日はこの溶解についてしつこくやっていこうと思う。
溶解というのは読んで字のごとく「溶ける」ってことだ。食塩水だったら、「塩が水に溶けている」ってわけだ。
ところで「溶ける」ってのはなんだろう?一体、どんな現象なんだろう?
え?考えたこともないって?
塩が水に溶けるなんて当たり前だろって?
じゃあ塩が水に溶けるって一体なんなのか説明できるかな。多分、できないと思う。
というわけで、まずは「溶ける」ってことについて考えていこうと思う。
水に溶ける物質
水に溶けるのは固体、液体、気体、なんでもござれだ。
水溶液の1回目で水に溶けるものを紹介したのはおぼえているかな?
これだ。
| 水溶液に溶けている物質の種類 | 水溶液の名前 | 溶けているもの |
| 固体 | 食塩水 | 食塩 |
| 砂糖水 | 砂糖 | |
| 石灰水 | 石灰(水酸化カルシウム) | |
| 重そう水 | 重曹(炭酸水素ナトリウム) | |
| 水酸化ナトリウム水溶液 | 水酸化ナトリウム | |
| ホウ酸水 | ホウ酸 | |
| 液体 | アルコール水 | アルコール(エタノール・メタノール) |
| さく酸水 | さく酸(酢) | |
| 気体 | アンモニア水 | アンモニア |
| 炭酸水 | 二酸化炭素 | |
| 塩酸 | 塩化水素 | |
| 亜硫酸 | 二酸化硫黄 |
あとはミョウバンとかも入試問題では出てくるね。
ミョウバンは固体で、水に溶かすと酸性。つまり電気を通す。
これも前回のおさらいだけど、イオンが発生して電気を通す水溶液を電解質の水溶液なんて呼んだりする。
逆に水に溶けてもイオンが発生せずに電気を通さない水溶液を非電解質の水溶液と呼ぶ。
同じ水に溶ける(溶解する)溶質でもイオンが発生するものと発生しないものがあるんだね。
つまり、同じような水に溶ける(溶解する)という現象にも2通りの溶け方があるってわけだ。
この違いを見ていこう。
2種類の溶解の違い
さて、2種類の溶解の違いを考えていくにあたって、塩と砂糖について考えていこう。
食塩水は電解質の水溶液。砂糖水は非電解質の水溶液だ。
塩が水に溶けるってのはどういうこと?
まずは食塩水からいくよ。
そもそも塩っていう物質はナトリウムイオンと塩化物イオンがくっついた物質だ。
ナトリウムイオンは電気的にプラスの性質を持っていて、塩化物イオンはマイナスの性質を持っている。
プラスとマイナスの物質が引き合うと、電気的にプラスマイナスゼロの物質になる。
それが塩だ。
このようにイオン同士が電気的な性質でくっついていることをイオン結合と呼ぶ。
こんなイメージだ。
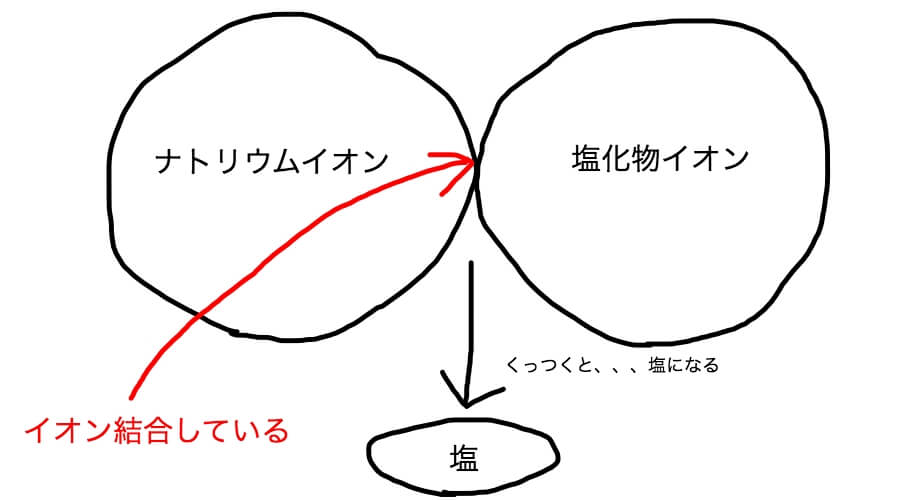
プラスとマイナスは惹かれあうんだ。
なんだかロマンチックだね。
そして無事、惹かれあったナトリウムイオンと塩化物イオンは塩になるんだけど、この仲を引きさくやつがいる。
それが水だ。
塩を水に入れると、ふたたびナトリウムイオンと塩化物イオンに引きさかれてしまう。
なぜかって?
水分子のちょっとした電気的性質が仲むつまじかった塩を電気的に引きさいてしまうからだ。
水分子は電気的にちょっとだけプラスの水素と、ちょっとだけマイナスの酸素からできている。
この性質が仲むつまじかったナトリウムイオンと塩化物イオンを引きさいてしまう。
こんなイメージだ。
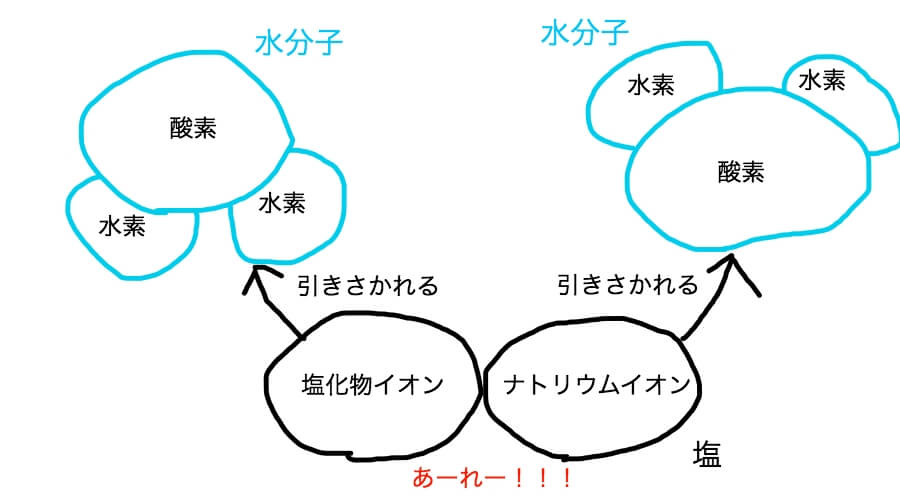
ちょっとだけ電気的にプラスの性質を持っている水素はマイナスの性質を持っている塩化物イオンを引っぱる。
ちょっとだけ電気的にマイナスの性質を持っている酸素はプラスの性質を持つナトリウムを引っぱる。
すると、何が起こるか。
そうだ。
塩はナトリウムイオンと塩化物イオンに引きさかれてしまうんだ。
このようにイオン結合していた物質が引きさかれてしまう現象を電離と言う。
実は塩を水に溶かすとこんな恐ろしいことが起きているってわけだ。
恐ろしいね、水。
塩のことを思うと涙なしには語れないよ。
砂糖が水に溶けるってどういうこと?
ここまではいいかな?
じゃあ、次は砂糖にいくよ。
砂糖は水に溶けるよね。でもイオンは発生していない。こういう水溶液を非電解質の水溶液って言うんだったね。
塩のようにイオンにはならない(電離しない)砂糖水の中では何か違うことが起きていそうだ。
さっそく見ていこう。
ここからはちょっと難しいことを説明する。中学、もしくは高校で習う内容だ。
水分子は、水素と酸素がくっついていると言ったね。
水分子のようなくっつき方を水素結合っていうんだ。
で、砂糖を水に入れるとどんどん小さい物質になっていく。もうこれ以上小さくなれないよ!ってところまで小さくなる。
君たちが見ている砂糖っていう物質は超いっぱいの分子が鎖のようにつながっている物質だ。
その鎖は水に入れるとどんどんほどかれて、やがてもうこれ以上小さくなれない分子レベルにまでなるんだ。
こんな感じだ。
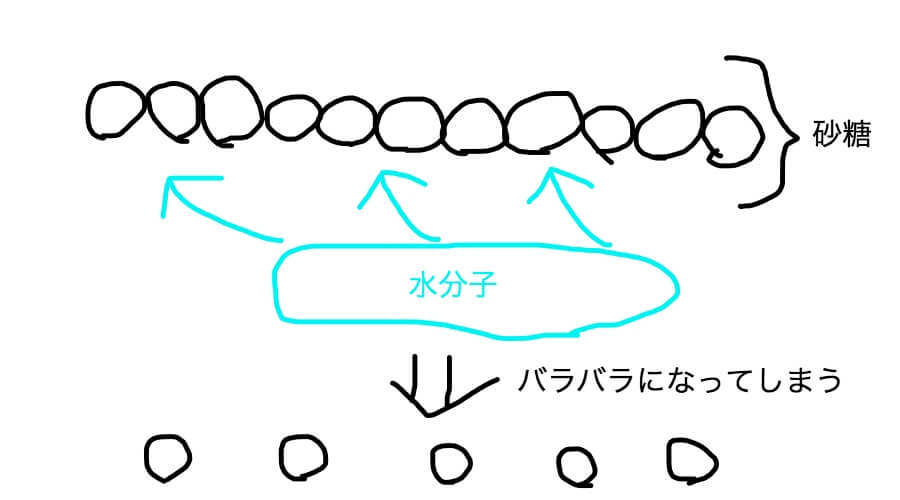
そしてバラバラになってしまった砂糖の分子は水分子に取り込まれてしまう。
正確に言おう。
水分子の持っているくっつく力(水素結合の力)で、砂糖の分子は水分子とくっついてしまい離れられなくなってしまう。
これが砂糖を水に入れた時に起きる現象だ。
イオンは発生していない。でも水分子によって目に見えないレベルまで小さくなっている。
だから、砂糖水は透明に見えるんだ。
分かったかな?
塩と砂糖は同じように水に溶けるけど、起きている現象は異なる。
塩はイオンにされてしまう。砂糖は分子にされてしまう。
両方とも目に見えないくらい小さい物質になるけれども、イオンは電気的性質を持っているし、分子は電気的性質を持っていない。
だから塩は電気を通すし、砂糖は電気を通さない。
同じ溶解でもちょっと違うことが起きている。
このことを頭に入れておいてほしい。
溶解度とはなんだろう?
溶解度というのはある量、ある温度における溶質の溶けやすさのことだ。
例えば100ml、20℃の水に塩は36グラムくらい溶ける。これ以上は溶けない。
この最大限度の量を溶解度という。
そして限界まで溶質が溶けた水溶液のことをなんて呼ぶかな?
YES!飽和水溶液だ。
そして、飽和水溶液にさらに溶質をぶち込んだらどうなるかな?
C’mon!溶けずに底に沈殿する。
「溶ける」っていうのは溶質が水とくっつくことだって言ったね。
溶解度というのはある量、ある温度の水とくっつくことができる溶質の限界とも言えるね。
ではさらに溶質を溶かすためにはどうすれば良いだろうか?
溶けやすくする(溶解しやすくする)にはどうするか?
さて、ここまで解説してきたようなことはかなり難しい話だ。
君たちがすごいなと思っているような大学、例えば早慶の大学生でも文系だったら半分も知らないんじゃないかな?
ここまでの説明を理解できた君たちは自信を持っていい。
では溶けやすくする(溶解しやすくする)にはどうしたらいいか説明していくよ。
参考書やテキストではこんな感じで説明されていると思う。
①固体は温度を上げると水に溶けやすくなる
②固体は水をかき混ぜると溶けやすくなる
③固体は水の量が多くなると溶けやすくなる
君たちも温度を上げたり、水の量を多くしたり、かき混ぜると溶けやすくなるのは、なんとなく理解できるんじゃないかな?
でもしつこいようだけれども僕は聞きたい。
それはなぜなんだ?
さあやっていこう。
どうして溶けやすくなるのか。
水の温度を上げると固体の溶質が溶けやすくなるのはなぜか?
実は温度を上げると固体の溶質が溶媒に溶けやすくなる、というのは全く正確な説明じゃない。
そりゃ、ミョウバンとか砂糖とかは確かに温度を上げると溶けやすくなるよ。
でも塩は温度をあげてもほとんど溶け方は変わらない。
水酸化カルシウムにいたっては温度を上げると逆に溶けにくくなる。
なぜか?
溶けるっていう状態は溶質がバラバラになって水分子とくっつく現象だって言ったね。
温度によってバラバラになりやすくなるなる溶質、バラバラになりにくくなる溶質がある。
だから、温度によって溶けやすくなったり、溶けにくくなったりするんだ。
温度が高くなると溶けやすいかどうかは溶質の性質によるってわけだ。
これを厳密に説明しようとするとめちゃくちゃ難しい説明が必要だ。君たちが理系の大学で化学を勉強することになるまでおあずけだ。
だから基本と例外に分けて覚えてしまおう。今はそれでいい。
温度と水の溶け方について表にしてまとめておいた。
◯は温度を上げると溶けやすい固体の溶質。×は温度を上げると溶けにくい溶質だ。
| 水溶液に溶けている物質の種類 | 溶質 | 温度を上げると溶けやすいか |
| 固体 | 塩 | ◯ |
| 砂糖 | ◯ | |
| 消石灰(水酸化カルシウム) | × | |
| 重そう(炭酸水素ナトリウム) | ◯ | |
| 水酸化ナトリウム | ◯ | |
| ホウ酸 | ◯ | |
| ミョウバン | ◯ |
基本と例外に分けて覚えよう。
基本:固体の溶質は温度を上げると水に溶けやすくなる。
例外:消石灰(水酸化カルシウム)は温度を上げると逆に水に溶けにくくなる。
ついでに、限界まで砂糖が溶けた砂糖水の温度を下げていくとどうなるのか考えてみよう。
砂糖は水の温度を上げると溶けやすくなる。逆に温度を下げると溶けにくくなる。
つまり、ある温度で限界まで水に溶けていた砂糖は、温度を下げると溶けなくなるんだ。
溶けなくなった砂糖は固体のつぶとして水の中に出てくる。
これを析出という。
そして、ゆっくり温度を下げていくとキレイな砂糖が再び姿を表す。
これを再結晶という。
ゆっくり温度を下げていかないと、いびつな形の砂糖の結晶が姿を表すことになるよ。
急いでいると間違いを犯すのは人間も砂糖も同じだ。
かき混ぜると固体が水に溶けやすくなる理由
ここらへんはさっくりいきたい。
塩や砂糖を水に入れてかき混ぜると溶けやすくなるよね。
ただ、かき混ぜると多くの量の塩や砂糖が溶けるってわけじゃない。
放っておくとやがて、塩も砂糖もある温度、ある量の水に限界量まで溶ける。かき混ぜなくてもね。
つまり、かき混ぜるってのは溶けるスピードを速くするってだけだ。
かき混ぜると、水とくっついていない砂糖の分子や塩が、同じく砂糖や塩とくっついていない水と混ざり合って溶解の速度が速くなる。
こんなイメージだ。
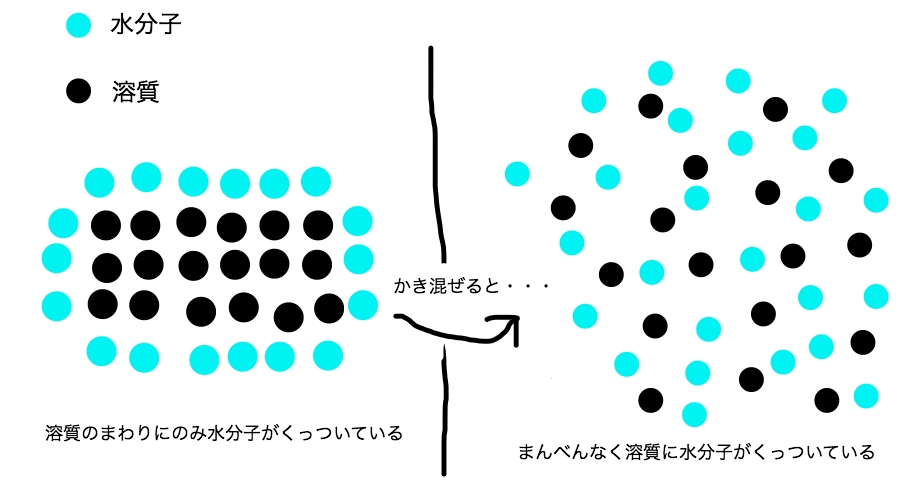
かき混ぜると水に溶質が溶けやすくなる理屈はわかったね?
しかしながら、ある温度の水に溶ける塩や砂糖の量は決まっている。
だから、温度が同じで水の量が同じだったらかき混ぜてもかき混ぜなくても最終的に溶ける量は変わらない。
あくまで溶解のスピードの問題だ。
水に溶ける溶質の量は水の温度が同じなら水の量に比例する
温度が同じだったら、水に溶ける塩や砂糖の量は水の量に比例する。水が多ければ多いほど多くの量が溶けるってわけだ。
ある温度の水分子がくっつくことのできる溶質の量は決まっている。どんな物質なのかによって違いはあるよ。
例えば、塩だったら100gで20℃の水には36gくらい溶けるけど、砂糖は200gくらい、重曹(炭酸水素ナトリウム)は10gくらい溶ける。
【まめ知識】作ってみよう!砂糖の結晶 農畜産業振興機構ウェブサイト
この数字は覚える必要はないよ。
覚えておいて欲しいのは、
水の温度と量によって溶質が溶ける量は決まってくる。
とくに温度が同じなら水の量と溶質が溶ける量は比例する。
だから、20℃で100gの水に砂糖が溶ける量は約200g。20℃で200gの水に砂糖が溶ける量は約400g。
水に溶けない溶質
最後に水に溶けない溶質を紹介して終わりにしよう。
例えば、こんなものが水には溶けない。
・鉄
・銅
・銀
・金
・アルミニウム
・石灰石(炭酸カルシウム) ← 卵のからもこれ
・ベンゼン
・ヨウ素
・メタン
などなど
溶質の分子の構造だったり、溶質の分子同士が結びついている力によって水に溶けるか溶けないかは決まってくる。
なんでも溶かしてしまうように見える水だけれども、溶質の形によってはくっつきずらいものがある。
そして水でも引き離せないほど力強くくっついた溶質もある。
水に溶ける=溶解ってなに? 一問一答 問題編
1.溶質が溶媒に溶けることを何と呼ぶか
2.ある温度、ある水の量のもとで溶質が溶ける限界量を何と呼ぶか
3.限界まで溶質が溶けた溶液を何と呼ぶか
4.飽和水溶液にさらに溶質を加えると溶けるかどうか答えよ
5.水に溶ける溶質の量は何によって決まるか。2つ答えよ
6.温度が同じとき、水の量と溶質の量は比例するか
7.飽和水溶液から溶けている溶質を取り出す方法を2つ答えよ
8.溶けていた溶質が固体になって出てくることを何と呼ぶか
9.飽和状態の砂糖水をゆっくり冷やして砂糖の結晶を取り出した。これを何と呼ぶか
10.砂糖は水の温度を上げると溶けやすくなるか
11.重曹(炭酸水素ナトリウム)は水の温度を上げると溶けやすくなるか
12.水酸化ナトリウムは水の温度を上げると溶けやすくなるか
13.ミョウバンは水の温度を上げると溶けやすくなるか
14.ホウ酸は水の温度を上げると溶けやすくなるか
15.消石灰(水酸化カルシウム)は水の温度を上げると溶けやすくなるか
16.100g、20℃の水に砂糖は約200g溶ける。200g、20℃の水には何g溶けるか
17.100g、20℃の水に炭酸水素ナトリウムは約10g溶ける。200g、20℃の水には何g溶けるか
18.水の量を同じとしたとき、温度と溶質の溶ける量は比例するか
19.次の中から水に溶けない物質を全て答えよ
粉末にした石灰、ミョウバン、鉄粉、アルミニウム板、細かく砕いた卵のから、消石灰、ヨウ素、ベンゼン
水に溶ける=溶解ってなに? 一問一答 解答編
1.溶解
2.溶解度
3.飽和水溶液
4.溶けない
5.水の量と温度
6.比例する
7.温度を変える、水を蒸発させる
8.析出
9.再結晶
10.溶けやすくなる
11.溶けやすくなる
12.溶けやすくなる
13.溶けやすくなる
14.溶けやすくなる
15.ならない
16.約400g
17.約20g
18.比例しない
19.粉末にした石灰、鉄粉、アルミニウム板、細かく砕いた卵のから、ヨウ素、ベンゼン
あわせて読みたい
最新のホカホカ記事
最新のホカホカ記事の一覧はこちらから書いている人の紹介
星一徹のプロフィールはこちらから- 前の記事

【中学受験】楽しい理科一問一答 水溶液② 水溶液の性質の表と覚え方 2019.04.24
- 次の記事

【中学受験】楽しい理科 水溶液④ 問題演習 2019.05.01

